近日医药化工学院童晓峰团队在《Angewandte Chemie》(德国应用化学,影响因子:16.6)发表研究论文“(3+2) Annulation of 4-Acetoxy Allenoate with Aldimine Enabled by AgF-Assisted P(III)/P(V) Catalysis”。这是该团队2023年发表的第四篇顶刊论文。
近十五年以来,P(III)/P(V)催化研究吸引了较多的关注,并取得巨大的进步,业已成为叔膦催化的研究热点和重点。目前,P(III)/P(V)催化大体可以分为两类:一是利用选择合适的叔膦催化剂和还原剂把五价P(V)=O再生成三价P(III)催化剂,从而实现磷的催化循环[P(III)/P(V)=O催化];二是充分利用五价P(V)物种的特有性质,例如配体偶联(ligand coupling),发展新颖的P(III)/P(V)催化。
童晓峰课题组基于他们前期的叔膦催化4-乙酰氧基联烯酸酯环加成研究工作,独辟蹊径,成功实现了一类全新的氟化盐协助的P(III)/P(V)催化。该工作具体的研究设计如图-1所示。
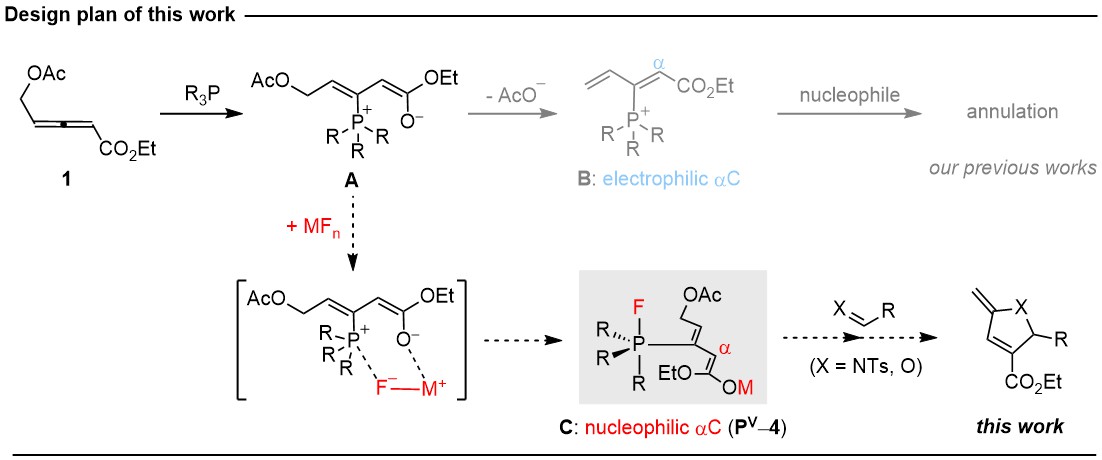
4-乙酰氧基联烯酸酯1在叔膦催化剂作用下可以快速转化成经典的烯醇氧负-鏻两性离子中间体A。童晓峰课题组过去十多年的研究主要利用中间体A的1,2-消除性质,形成1,3-双烯鏻正离子中间体B。很显然,中间体B是一类亲电试剂,能够和各类亲核试剂发生环加成反应。在本工作中,他们另辟蹊径,试图通过加入合适的金属氟化盐MFn,基于氟负离子F-和鏻正离子以及氧负离子和Lewis酸性金属Mn+之间的强亲和性,引发中间体A和MFn的更加快速的复分解反应,从而转化成enolate metal-fluorophosphorane中间体 C。这是一类新颖的中间体(图-1),其中的烯醇金属enolate metal使其具有亲核反应性,实现了aC的极性反转;而五价氟膦烷fluorophosphorane则提供了额外的反应位点。
基于上述在机理方面的思考,并通过反应条件优化,最终他们确定AgF是最好的氟化盐试剂,并用三乙胺作为碱添加剂,可以顺利实现联烯酸酯1和各类亲电试剂的(3+2)环加成反应,如亚胺、活化的酮等。

图-2:可能的反应机理
通过控制实验和关键中间体的捕捉,作者提出了可能的反应机理(图-2)。首先PPh3通过Michael加成活化底物1a形成鏻翁氧负离子中间体,然后与AgF相互作用形成烯醇化银氟膦烷C。随后,中间体C和亚胺2a发生Mannich反应,得到中间体D。可能是由于氟膦烷吸电子效应较弱,导致D中的磺酰胺阴离子没有和氟膦烷乙烯基加成,而是作为碱使乙酰氧基团发生E2消除,形成了联烯基氟膦烷中间体F。在碱的存在下,中间体F中的磺酰胺和高活性的联烯基发生加成-消除过程,产生磷叶立德G。最后,通过质子转移和1,2-消除重新释放PPh3和环化产物3aa完成催化循环。
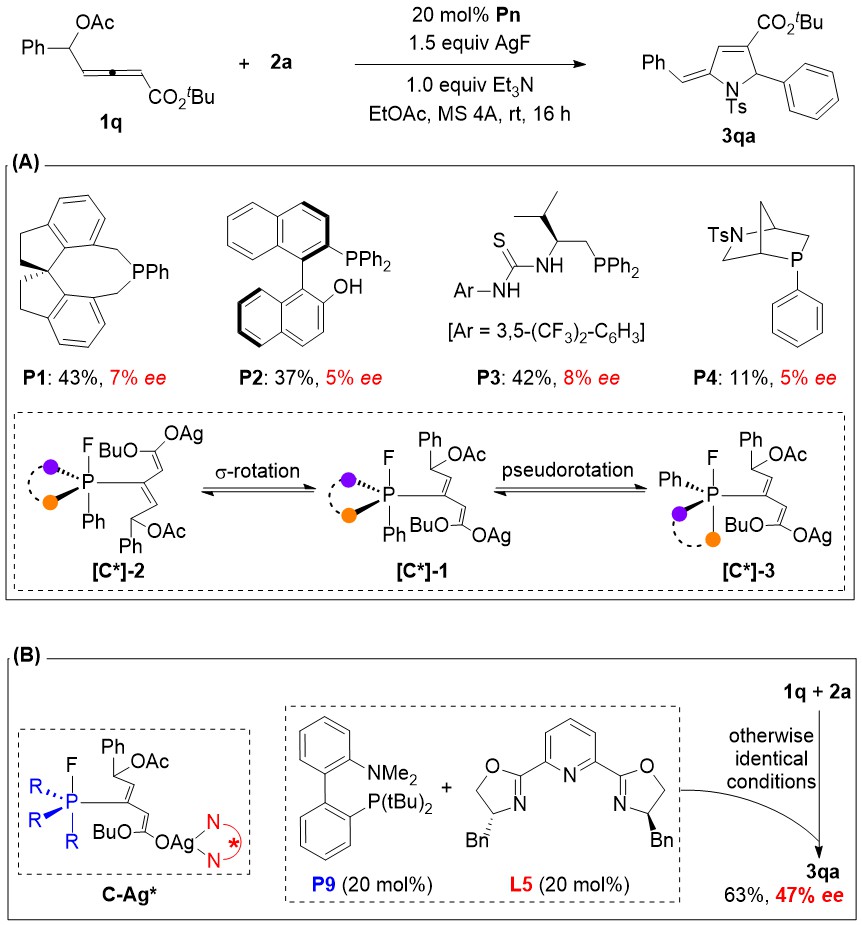
图-3:不对称催化的初步尝试
作者也初步尝试了该反应的不对称催化。但是令人意外的是,非常广谱和高效的手性叔膦催化剂P1-P4都给出了小于10%的对映选择性(图-3)。于是他们大胆猜测:该反应涉及到fluorophosphorane P(V)中间体C,该中间体和亚胺之间的Mannich反应是手性决定步骤。但是,五价P(V)的各个配体之间非常容易发生位置互换,其构象并不固定,这必然会给涉及P(V)中间体的不对称催化带来意想不到的困难。另辟蹊径,他们最后发展出了非手性膦催化剂和手性PyBox配体协同不对称催化的策略,虽然目前只获得了中等的对映选择性。尽管如此,该策略为发展不对称P(III)/P(V)催化打开了一扇新的大门。
总之,童晓峰教授团队发展了AgF协助的P(III)/P(V)催化,实现了4-乙酰氧基联烯酸酯和亚胺的(3+2)环加成反应。通过控制实验和关键中间体的跟踪,证明了金属烯醇化物氟膦烷中间体的存在,并且相较于传统膦催化实现了4-乙氧基联烯酸酯底物反应位点的极性反转,完成了不同于传统膦催化新型反应模型的构建,为膦催化提供了更多的想象空间。
本研究工作主要由钱金龙博士完成,童晓峰教授为该论文的通讯作者。该项研究得到了国家自然科学基金和台州学院的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202315188